부검에서 우연히 발견된 선천성 좌측 완전 심낭막 결손: 증례보고
Congenital Complete Left-Sided Absence of the Pericardium Incidentally Identified in the Autopsy: A Case Report
Article information
Trans Abstract
Congenital absence of the pericardium, also known as pericardial agenesis, is an extremely rare anomaly. Although most cases are asymptomatic, some experience chest pain, dyspnea, dizziness, and syncope. A few sudden death cases have been reported. We report a case of congenital complete left-sided absence of the pericardium that is not related to the cause of death. In the autopsy of a skinny 45-year-old deceased man, there was no left pericardium, and the heart had direct contact with the left lung. Inflammation and adhesion around the heart, torsion of great vessels, structure abnormality of the heart, and histologic lesion of the myocardium were absent. Due to the chemical analysis result and morphology, we suspected that the cause of death was related to starvation. The congenital absence of the pericardium is usually accompanied by myocardial infarction, aortic dissection, and variable congenital anomalies in the heart and other organs. Additionally, both complete and partial defects can cause myocardial infarction. Therefore, we suggest that precise gross examination should be performed to determine the ischemic lesions in the heart and other anomalies if congenital absence of the pericardium is noted in the autopsy.
서 론
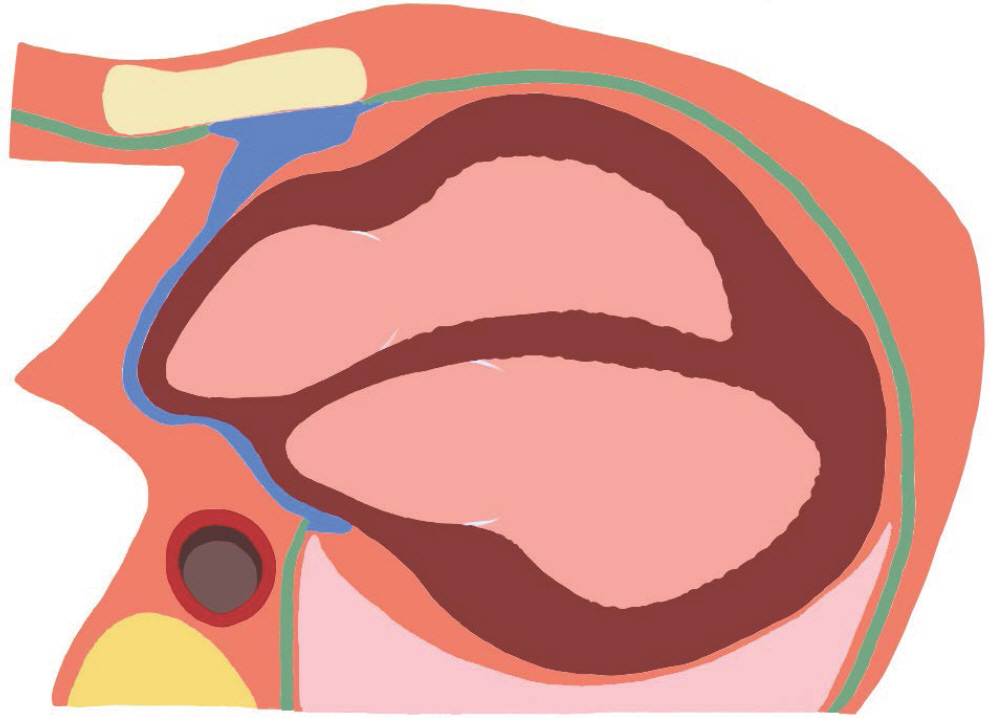
선천성 심낭막 결손(congenital absence of the pericardium 또는 congenital pericardial agenesis)는 매우 희귀한 선천성 심낭막 기형이다[1]. 심낭막은 1-2 mm 두께의 주머니 형태의 질긴 결합조직으로 이루어진 심장을 둘러싸고 있는 막으로 심장의 위치를 안정적으로 유지하고, 심장이 박동하는 동안 마찰을 감소시키고, 심실의 수축과 확장 시 압력을 유지 시켜 주고, 외부 가속력에 대해 완충하는 기능을 한다[2]. 선천성 심낭막 결손으로 인한 증상이 없는 경우가 많으나 결손 부위와 면적에 따라서 증상이 다르게 나타날 수 있다. 주로 명료하지 않은 흉통이 나타나고, 호흡곤란이나 어지러움, 실신을 동반하기도 하며 일부에서 급사하는 사례도 있다[3]. 증상이 있으면 영상의학적으로 진단되는 경우도 있으나[4], 급사하여 부검에서 심근경색과 함께 선천성 심낭막 결손이 발견되기도 한다[5–7]. 저자들은 다른 사인으로 사망하였다고 생각되지만 우연히 좌측 완전 심낭막 결손(complete left-sided absence of the pericardium)이 발견된 부검 사례를 경험하여 보고하고자 한다.
증례 보고
특별한 질병력이 없는 45세 남성이 4개월 전 가출하여 그 동안의 행적을 알 수 없었고, 1월초 사람이 살지 않는 빈 집에서 사망하였다. 발견 장소는 본채와 마당을 공유하며 하나의 담장 안에 있는 별채이고, 대문은 끈으로 묶었기 때문에 쉽게 출입이 가능하였다. 별채는 10년 전에 침수가 되고 난 이후 창고로 사용하고 있었다. 본채의 거주자인 발견자는 살아있는 변사자를 목격한 적이 없었고, 별채에 물건을 찾으러 들어갔다가 변사자를 발견하였다. 변사자는 두꺼운 외투까지 옷을 모두 입고 있는 상태였고, 양말을 두 켤레를 겹쳐 신고 있었다. 발견 당시 장판이 없는 콘크리트 방바닥에 반듯이 누운 자세였다. 변사자의 소지품은 한쪽에 모여 있었고, 다툼의 흔적이나 혈흔은 발견되지 않았다. 발견자가 마당에 보관 중인 생수와 같은 빈 생수병이 발견되어 변사자가 마당의 생수를 가져다 마신 것으로 추정되었다. 가출 이전에 비하여 체중이 많이 감소한 것으로 보였고, 모발과 수염, 손톱이 정리되지 않은 상태였다.
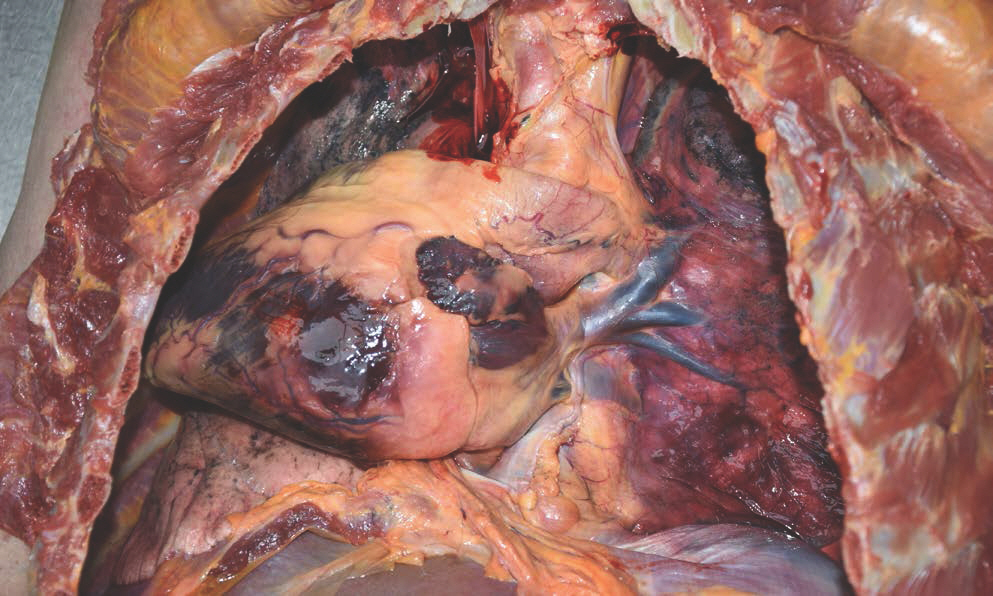
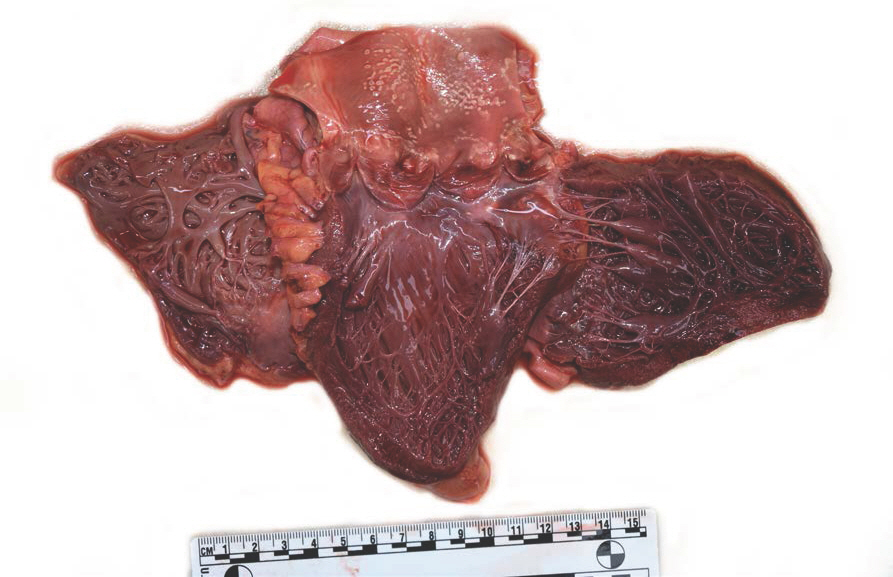
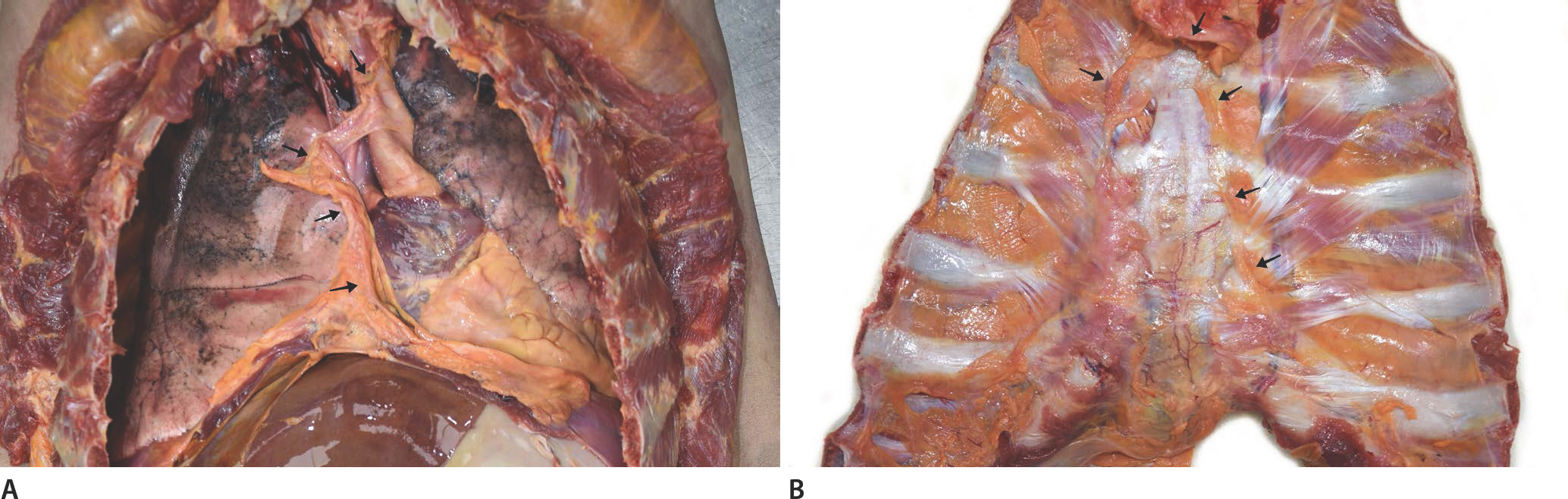
부검 당시 시신은 키는 172 cm, 몸무게는 45 kg, 부패 초기 단계이고, 시반은 미약하며, 시강은 소실된 상태였다. 전신에서 뼈가 다 드러나 보일 정도로 피하지방이 감소하였으며, 특히 복부가 홀쭉하게 들어간 형태를 보였다. 오른쪽 무릎과 꼬리뼈 부분에 표피박탈이 있었고, 딱딱한 콘크리트 바닥에 누워 있다가 생긴 것으로 추정되었다. 외표에서는 사망에 이를 만한 외상이 없었다. 늑골을 자르고 종격동을 보았을 때, 절단해야 할 연부조직이 거의 없었다. 그리고 흉강에서 오른쪽 폐와 심장을 나누는 심낭막은 있었으나 왼쪽 폐와 심장 사이에는 심낭막이 없었고, 상행대동맥과 이어져 있으나 대동맥의 오른쪽만 감싸고 있는 형태였다. 심장은 왼쪽으로 크게 치우쳐져 있었고, 직접 왼쪽 전흉부의 벽측흉막(parietal pleura)과 왼쪽 장측흉막(visceral pleura)과 맞닿아 있었다(Figs. 1, 2). 심장과 흉막 사이의 유착이나 대혈관의 염증과 염전, 협착 소견은 없었다(Fig. 3). 심장의 무게는 360 g이고, 심장 내부 구조와 관상동맥, 심근 단면에서 이상 소견은 없었다(Fig. 4). 왼쪽 폐의 무게는 345 g, 오른쪽 폐의 무게는 405 g이었고, 기관지와 폐혈관, 실질에서 이상 소견은 없었다. 위 내용물은 80 mL 정도의 액상 형태였다. 현미경적 검사에서 다수의 심근 절편을 확인하였지만 심근에서 이상 소견을 볼 수 없었고, 다른 장기에서도 이상 소견은 없었다. 비록 선천성 심낭막 결손이 확인되었으나, 이로 인한 심근 병변이나 같 이 동반할 수 있는 다른 심장 기형은 확인할 수 없었기 때문에 선천성 심낭막 결손 자체로 인하여 사망하였을 가능성은 낮다고 생각되었다.
The heart, lungs, and right-sided pericardium (arrows) in the thoracic cavity. (A) The left posterior displacement of the heart and absence of the left-sided pericardium. (B) Internal side of the anterior chest wall.
부패 초기 단계였지만 소량의 혈액과 눈유리체액을 채취하여 임상화학적 검사를 시행하였다. 혈액에서 약독물이나 에탄올은 검출되지 않았고, 베타-히드록시부티레이트(β-hydroxybutyrate)와 아세톤 농도는 418 mg/L와 43 mg/L 로 증가하였다. 눈유리체액 임상화학검사에서 포도당 농도는 155 mg/dL로 증가하였고, 요소질소 농도는 40.9 mg/dL로 증가하였으나, 크레아티닌(creatinine) 농도는 1.07 mg/dL로 정상 범위였다. 나트륨 이온과 염소 이온 농도는 106 mEq/L 과 76 mEq/L으로 크게 감소하였다. 혈액에서 당화혈색소 검사를 시도하였으나 채취된 혈액이 응혈되어 검사가 불가능하였다.
변사자의 피하지방이 거의 없을 정도로 체중이 감소하였다는 점에서 최근에 장기간의 공복이 있었을 것으로 추정되었고, 현장에 빈 생수병이 있었다는 점에서 수분은 지속적으로 공급받았을 것으로 생각되었다. 베타-히드록시부티레이트와 아세톤이 증가하는 원인은 당뇨병의 합병증이나 만성알코올 중독, 장기간의 공복을 생각해볼 수 있다[8]. 먼저 변사자는 평소에도 술을 거의 마시지 않았다고 하며, 현장에서도 다량의 음주를 확인할 만한 증거물이 없었기 때문에 만성알코올중독의 가능성은 배제하였다. 변사자의 경우에는 장기간 공복과 함께 눈유리체액의 포도당이 증가하였다는 점에서 당뇨병의 합병증, 특히 혈중 나트륨 이온과 염소 이온의 감소를 동반하는 당뇨병성 케톤산증(diabetic ketoacidosis)을 의심해볼 수 있었다. 하지만 생전에 당뇨병을 진단받은 적이 없었으며 당화혈색소 수치를 확인할 수 없었기 때문에 당뇨병성 케톤산증으로 단정지을 수는 없었다. 그리고 당뇨병이 없었다고 하더라도 장기간의 공복 상태에서 다량의 수분만을 섭취하면서 점차적으로 진행된 전해질 불균형으로 사망할 수도 있다고 생각되었다. 비록 정확한 사망의 기전은 파악하기 어려우나 장기간의 공복에 의한 영향으로 사망하였다고 추정되었다.
고 찰
선천성 심낭막 결손은 좌측 완전 결손이 가장 흔하고, 양측 완전 결손과 좌측 부분 결손, 우측 완전 결손은 드물다. 여자보다는 남자에서 흔하며 우측보다는 좌측이 흔하고, 좌측 심낭막에서 발생한 경우 부분 결손보다 완전 결손이 더 흔하다고 알려져 있다[9]. 일반적으로는 선천성 심낭막 결손은 만명 중 1명 이하로 발생한다고 하며, 부검에서는 13,000 부검 중에 2건이 나온 연구와 14,000 부검 중 1건이 나온 연구가 있었다[10]. 한국에서는 임상 증상이 있어서 검사 중에 발견되거나 수술 중에 우연히 발견된 사례가 수차례 보고 되었으나, 부검 중에 발견된 증례는 보고된 바가 없다. 선천성 심낭막 결손의 원인은 심낭막의 발달 과정에서 찾고 있다. 태아 발달 4주 이후에 양쪽 가슴심장막(pleuropericardial membrane)이 서서히 융합되어 심장막복막관(pericardioperitoneal canal)이 심낭(pericardial cavity)과 흉강(pleural cavity)으로 분리되면서 심낭막이 만들어진다. 이 과정에서 가슴심장막 안에 있는 온기본동맥(common cardinal vein)이 조기수축이 된다면 혈액 공급이 차단되어 가슴심장막이 융합이 되지 못하여 심낭막이 형성되지 않는다는 것이 가장 유력한 가설이다[11]. 심장 수술 중에 선천성 심낭막 결손이 발견된 환자를 대상으로 한 연구에서 선천성 심낭막 결손 이외에 다른 선천성 기형을 동반하고 있는 경우가 30%-50%였고, 발견된 기형으로는 심방중격결손(atrial septal defect), 동맥관개존증(patent ductus arteriosus), 팔로사징(Fallot tetralogy), 기관지낭(bronchogenic cyst), 폐분리증(pulmonary sequestraion)이 있었다[12]. 드물게는 바테르 증후군(VATER syndrome)과 팰리스터-킬리언 증후군(Pallister-Killian syndrome) 같이 다양한 기형을 동반하는 증후군에서 선천성 심낭막 결손이 같이 발견된 경우도 있었다[13,14].
대부분의 선천성 심낭막 결손은 결손 자체로 인한 증상이 나타나지 않아 우연히 수술이나 부검 중에 우연히 발견되는 경우가 많다. 그럼에도 불구하고 선천성 심낭막 결손으로 인하여 급사하는 경우가 있다. 선천성 부분 심낭막 결손일 경우에 결손 부위로 심장의 일부가 탈장이 되어 교액되고, 교액된 부분이 허혈 상태가 되어 급사할 수 있다[5,6]. 주로 탈장되는 부분은 왼쪽 심방귀(left atrial appendage)이지만, 좌심방이나 좌우심실 전체가 탈장되는 사례도 있다[10]. 알려져 있다. 탈장이 일어나지 않는 왼쪽 완전 심낭막 결손에서도 현미경적 검사에서 심근경색이 확인된 사례가 있었다[7]. 선천성 심낭막 결손이 있으면서 type A 대동맥 박리가 발생하는 사례가 6건 보고되었는데, 흥미로운 점은 대동맥 박리 이후에 심낭 안에 피가 고이지 않고 바로 흉강으로 피가 고이게 되어 심낭 압전이 발생하지 않는다는 점이다[15–17]. 심낭 압전이 없기 때문에 증상이 저혈량쇼크로 나타났고, 이로 인해 수술 후 생존할 가능성이 증가하였다. 원래 드문 기형인 선천성 심낭막 결손에서 대동맥 박리가 상대적으로 빈번히 발생하기 때문에 선천성 심낭막 결손이 대동맥 결합조직 질환과 관련이 있다거나, 심낭막이 없어서 심장의 위치를 안정적으로 유지해주지 못하기 때문에 상행대동맥의 과도한 움직임이 일어나 type A 대동맥 박리가 일어난다는 의견이 있다. 일부 심비대를 동반한 사례들이 보고되기는 하나 아직 통계적인 유의성을 찾기는 어렵다.
마지막으로 저자들은 국내 부검 상황에 맞춰 선천성 심낭막 결손이 부검에서 발견되었을 때 고려해야 할 점들을 정리해보고 한다. 사후 전산화단층촬영을 할 수 있다면, 직접적으로 심낭막이 없다는 점과 좌후방으로 심장이 크게 치우치는 현상을 볼 수 있다. 심낭막이 없다는 것은 놓치기 쉬운 소견이지만, 심장이 좌후방으로 치우치는 현상은 쉽게 확인이 가능한 소견이라고 생각된다. 사후 전산화단층촬영 없이 부검을 하는 경우에는 흉강을 열고 나서야 심낭막의 부재를 알게 되기 때문에 가능한 남아있는 심낭막을 확인하여 무슨 종류의 선천성 심낭막 결손인지 확인하여야 한다. 부분 결손이 있는 경우에는 탈장 된 심장 조직이 확인될 수 있다[9]. 이때는 결손 부위 주변의 심낭막이 섬유화되어 두꺼워져서 빠져나온 심장을 누를 수 있는데, 그때 주요 관상동맥을 압박하는 부위가 있는지 확인하여야 한다. 완전 결손일 경우에는 심장과 폐사이에 유착이 있는지 대혈관의 염증이나 염전, 협착이 없는지 확인하여야 한다. 다양한 심장의 기형이 동반될 수 있으므로, 육안검사시 심장의 구조를 자세히 살펴야 한다. 부분 결손뿐만 아니라 완전 결손에서도 심근경색이 있을 수 있다는 점을 유념하고, 심장의 다양한 위치에서 충분한 심근 절편을 만들어 관찰하여야 한다. 폐의 기관지낭이나 폐분리증을 비 롯하여 알려지지 않은 다른 장기의 선천성 기형이 동반될 수 있으므로 흉부 및 복부 장기의 육안검사를 할 때에도 역시 주의를 기울여야 한다.
본 증례에서는 장기간의 공복 여부와 케톤산증, 저나트륨혈증, 고혈당이 확인되어 선천성 심낭막 결손이 사인일 가능성은 먼저 배제할 수 있었다. 하지만 선천성 심낭막 결손이 유일한 부검 소견이었다면 심장에서 사인을 찾기 위해 더 많은 노력을 기울여야 했을 것이다. 선천성 심낭막 결손이 매우 드문 심낭막 기형이며 국내 의료 환경상 흉부 단순촬영으로 대부분은 생전에 진단받았거나 치명적인 기형이 동반되었을 경우에는 어렸을 때 진단되었을 가능성이 높아서 부검에서 발견되는 경우는 외국의 사례에 비해서 더욱 드물 것으로 생각된다. 위와 같이 저자들의 경험을 공유하면서 부검 중에 우연히 선천성 심낭막 결손을 발견하였을 때 주의해서 확인해야 할 점들을 제안하고자 한다.
Notes
Conflicts of Interest
Jinhyuk Choi, a contributing editor of the Korean Journal of Legal Medicine, was not involved in the editorial evaluation or decision to publish this article. All remaining authors have declared no conflicts of interest.